Строение атома. Периодический закон и периодическая система химических элементов.
Значимость темы: Изучение строение электронных оболочек атомов в свете современной квантовой теории имеет большое значение, так как позволяет теоретически обосновать заполнение энергетических уровней еще не открытых элементов и для предсказания и характеристики свойств новых химических элементов, дает возможность предвидеть их реакционную способность. Учение о строении атома привело к открытию ядерной энергетики и использованию ее для нужд человека. Периодический закон и периодическая система Д.И. Менделеева с точки зрения современной теории строения атомов формирует самопознание студентов путем постановки проблемных вопросов по предсказанию новых химических элементов, строению их атомов, дает возможность им описать химические свойства элементов и их соединений.

Цель занятия: Научить теоретически обосновать заполнение энергетических уровней атомов электронами и составлять электронные формулы атомов всех элементов периодической системы для предсказания и характеристики их свойств.
Информационно – дидактический блок
Атом – сложная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома – положительно заряженная центральная часть атома, в которой сосредоточена основная часть массы атома. Радиус ядра примерно равен 10 -13 см.
Ядро состоит из элементарных частиц двух типов: протонов (Z – обозначение их числа) и нейтронов (N – обозначение их числа). Общее название этих частиц – нуклоны . Общее число нуклонов в ядре называется массовым числом А:
A = Z + N
Заряд ядра Z равен числу протонов в ядре и атомному номеру (порядковому номеру элемента в периодической таблице, закон Г. Мозли, 1913).
Химический элемент – вид атомов, характеризующийся одним и тем же зарядом ядра.
Нуклиды – различные виды атомов. В обозначении нуклидов порядковый номер элемента пишут слева внизу от символа нуклида, а массовое число – слева вверху. Например:
14 7 N, 16 8 O, 35 17 Cl, 56 26 Fe
Изотопы – нуклиды с одинаковым Z, но различными А и N.
Изотопы – это атомы одного и того же элемента, имеющие одинаковый заряд ядра, но разные массовое число. Обычно изотопы различных элементов не имеют специальных названий. Исключением является водород, изотопы которого имеют специальные химические символы и названия:
1 1 H - протий; 2 1 D - дейтерий; 3 1 T - тритий
При образовании ядра из протонов и нейтронов часть массы превращается в энергию, которую называют энергией связи ядра. Эта энергия связана с массой соотношением Эйнштейна:
E = mc 2
где С = 3 · 10 8 м/с – скорость света.
Электрон (ê) – элементарная частица, входящая в состав атома
Заряд ê = 1,6 · 10 -19 Кл;
Масса ê = 0,0005486 а.е.м.;
Спин ê = 1/2;
Открыт Дж. Томпсоном в 1897 г.
Теория Бора – квантовая теория, описывающая движение электрона в атоме водорода. Предложена в 1913 г датским физиком Нильс Бором.
m · V · r =
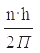
где m – масса электрона m = 9,1 · 10 -31 кг
n – номер орбиты (n = 1, 2, …..);
h = 6,626 · 10 34 Дж·с – постоянная Планка;
Атом испускает или поглощает электромагнитное излучение только при переходе с одной орбиты на другую. Частота излучения ν связана с энергиями орбит Е 1 и Е 2 соотношением Планка:Е 1 – Е 2 = h · ν
где
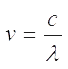 .
.
Энергия электрона на n-ой орбите равна:
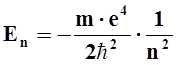 ;
;
где ê – заряд электрона.
Теория Бора не применима для многоэлектронных атомов.
Квантовая механика – эта физическая теория устанавливающая законы движения микрочастиц (электронов, ядер).
Квантовые свойства электрона
1. Электрон имеет двойственную (корпускулярно – волновую) природу. В разных экспериментах электрон может вести себя и как частица, и как волна: подобно частице электрон обладает определенной массой и зарядом; в то же время электрон проявляет волновые свойства, например, способность к дифракции.
Связь между корпускулярными и волновыми свойствами электрона выражается соотношением де Бройля:
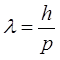 ,
,
где λ - длина волны электрона;
р – его импульс, т.е. произведение массы электрона на скорость;
ħ – постоянная Планка;
2. Принцип неопределенности Гейзенберга:
Положение и скорость электрона невозможно одновременно измерить с абсолютной точностью (чем точнее изменение импульса, тем больше неопределенность в координате и наоборот). Это свойство связано с тем, что ввиду микроскопичности электрона изменение одних его свойств вызывает большое воздействие на другие свойства; чем точнее изменение, тем больше его воздействие.
Связь между погрешностями изменения координаты ΔХ и скоростью ΔV электрона выражается соотношением неопределенности:
ΔХ · m · ΔV >
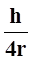
Из этого соотношения следует, что движение электрона в атоме нельзя описать с помощью траектории, т.к. координата и скорость точно не определены. Можно лишь рассчитать вероятность его нахождения в разных областях.
Атомная орбиталь – область пространства, где чаще всего находится электрон, это функция, зависящая от трех пространственных координат ψ(x, y, z), которая описывает вероятность нахождения электрона в разных точках пространства вокруг ядра атома. Это функция называется волновой функцией электрона.
Квадрат модуля волновой функции /ψ (x, y, z)/ 2 пропорционален вероятности нахождения электрона в точке с координатами x, y, z.
Для нахождения волновой функции надо решить основное уравнение квантовой механики – уравнения Шредингера:
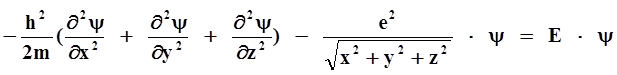
где ê – заряд электрона;
m – масса электрона;
Е – энергия.
Волновое уравнение Шредингера – это математическая модель атома. Она отражает единство корпускулярных и волновых свойств электрона. Волновая функция, являющаяся решением уравнения, называется атомной орбиталью. Описать атомную орбиталь, т.е. каждое состояние электрона в атоме, можно с помощью набора квантовых чисел, значения которых входят в уравнение Шредингера.
Квантовые числа полностью описывают состояние электрона в атоме.
1. Главное квантовое число n определяет общую энергию электрона на данной орбитали (номер энергетического уровня). Оно принимает любые целые значения, начиная с единицы:
n = 1, 2, 3 …. ∞
Главное квантовое число, равное ∞, означает, что электрон улетает из атома, и атом превращается в ион.
Энергетический уровень – совокупность всех орбиталей с одним и тем же значением n.
| Уровни с номерами | n = 1, 2, 3, 4, 5, 6, 7…. |
| обозначают | K, L, M, N, O, P, Q….. |
Максимальное число электронов на энергетическом уровне определяют по формуле:
N = 2n 2
n = 1 N = 2ê
n = 2 N = 8ê и т.д.
2. Орбитальное квантовое число l - характеризует форму электронной орбитали, при заданном главном квантовом числе n орбитальное квантовое число может принимать любые целые значения от 0 до (n - 1).
l = 0, 1, 2, …. (n - 1) всего - n разных значений.
Орбитали с l = 0 называют s – орбиталями;
с l = 1 называют p – орбиталями;
с l = 2 называют d – орбиталями;
с l = 3 называют f – орбиталями.
Орбитали с более высокими значениями l обозначают в алфавитном порядке l = 4 → g; l = 5 → h и т.д.
Подуровень – совокупность всех орбиталей с одинаковыми значениями n и l, например, 3s – подуровень, 4p – подуровень и т.д.
3. Магнитное квантовое число m l характеризует ориентацию орбитали в пространстве. При заданном числе l оно может принимать любые целые значения от –l до +l, включая 0:
m l = –l, 0, +1; всего m l = (2l + 1) значений.
4. Спин s - собственный момент импульса электрона (англ. spin – веретено), характеризует вращение электрона вокруг своей оси.
Спин электрона s =
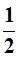 .
.
Магнитное спиновое число m s – проекция собственного момента движения электрона на избранном направлении (например, ось z). Она может иметь лишь два значения:
m s = +
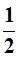 ; –
; –
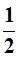 ;
;
Поскольку спин электрона s – величина постоянная, его не включают в набор квантовых чисел.
Распределение электронов в атоме по орбиталям называется электронной конфигурацией атома.
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p….;
Правило Хунда : при заполнении p, d и f – орбиталей в основном состоянии атом имеет максимально возможное число неспаренных электронов в пределах определенного подуровня. Например, если на 2р – подуровне находятся три электрона, то они должны находиться на трех разных орбиталях: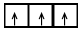 .
.
В этом случае суммарный спин максимален и равен:
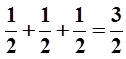
Принцип наименьшей энергии и правило Хунда могут нарушаться в возбужденных состояниях атома, где электроны могут занимать любые существующие орбитали. Принцип Паули всегда справедлив в любых электронных состояниях.
Порядок заполнения электронами атомных орбиталей определяются правилами Клечковского, которые учитывают зависимость энергии орбитали от значений главного (n) и орбитального (l) квантовых чисел.
1 правило Клечковского: атомная орбиталь заполняется электронами в порядке последовательного возрастания суммы главного и орбитального квантовых чисел (n + l).
2 правило Клечковского: в группах с одинаковыми значениями суммы главного и орбитального квантовых чисел (n + l) первыми заполняются уровни с меньшим значением главного квантового числа n.
На основании изучения линейных спектров атомов была установлена следующая последовательность по энергии атомных орбиталей для многоэлектронных атомов:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f = 5d < 6p < 7s < 6d < 7p < 6f < 7d и т.д.
Закономерности изменения электронных конфигураций элементов отображены в Периодическом законе, который был сформулирован Д.И. Менделеевым 1 марта 1869 года.
Периодический закон: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины их атомных весов.
Периодический закон в точки зрения строения атома: Свойства элементов и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
Химические свойства элементов и их соединений определяются строением электронной оболочки атома.
Валентные электроны - электроны, расположенные на внешнем и пред внешнем электронном слое атома.
При увеличении заряда ядра увеличивается общее число электронов и периодически изменяется конфигурация валентных электронов, что приводит к периодическому изменению свойств элементов.
Х → Х + + ê
Наименьшие потенциалы ионизации у щелочных металлов; наибольшие – у инертных газов; Сродство к электрону – энергия, которая выделяется при присоединении электрона к атому:Х + ê → Х - ;
Электроотрицательность атома (ЭО) – способность атома притягивать к себе валентные электроны других атомов;Для количественного определения электроотрицательности применяют шкалу относительныхэлектроотрицательностей, Л. Полингом в 1932году (см. таблицу №5 в приложении);
По шкале Полинга наиболее электроотрицательным элементом является фтор, наименее – щелочные металлы;
Периодические изменение или периодичность означает повторение физических и химических свойств элементов через определенные интервалы (интервалы в 8 или 18 элементов).В группах (подгруппы А и В) наблюдается вторичная периодичность. Энергия ионизации атомные радиусы и другие свойства изменяются немонотонно.
d - и f - сжатие. В пределах семейств d - и f - элементов наблюдается плавное уменьшение оболочки атомов. Это уменьшение называют d - и f - сжатием. В подгруппах А радиусы атомов и однотипных ионов увеличиваются.
На характер изменения радиусов атомов в подгруппах В влияют эффекты d - и f - сжатия.
Примеры решения типовых задач
Пример 1. Вычислить массу фотона, длина волны которого равна 589 · 10 -9 м.
|
Дано:
λ = 589 · 10 -9 м h = 6,626 · 10 -34 Дж·с c = 3 · 10 8 м/с |
Решение:
Записать уравнение де Бройля и из него вычислить массу фотона:
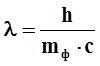
где m - масса фотона; h - постоянная Планка; λ - длина волны; c - скорость фотона (равна скорости света). Подставить значения и вычислить массу фотона:
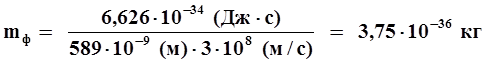
|
| m фотона = ? |
Пример 2. Чему равны абсолютная и относительная массы атома марганца?
Решение:
Относительная масса атома (А r ) показывает во сколько раз абсолютная средняя масса одного атома элемента больше, чем 1/12 часть массы изотопа углерода С (измеряется в атомных единицах масс = а.е.м.):
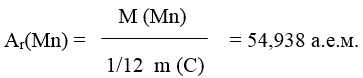
Абсолютная масса (m) рассчитывается:
6,02 · 10 23 атомов Mn (1 моль) --- 54,938 г
1 атом Mn --- х г
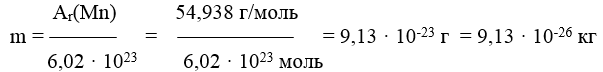
Пример 3. Какой подуровень заполняется в атоме электронами после заполнения подуровня 4p?
Решение:
Подуровню 4р отвечает сумма (n + l) равна 4 + 1 = 5.
Такой же суммой n + l характеризуются подуровни 3d(3 + 2) = 5 и 5s(5 + 0 = 5)
Однако состоянию 3d отвечает меньшее значение n(n = 3), чем состоянию 4p. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу больше значение n(n = 5). (I правило Клечковского).
Пример 4. Какой подуровень будет заполняться вслед за подуровнем 4s?
Решение:
Подуровню 4s соответствует сумма n + l = 4 + 0 = 4. Такой же суммой n + l характеризуются подуровень 3p, но заполнению этого подуровня предшествует заполнению 4s, т.к. ему отвечает большее значение главного квантового числа. Следовательно, после подуровня 4s будет заполняться подуровень с суммой n + l = 5, причем из всех возможных комбинаций n + l, соответствующих этой сумме (n = 3, l = 2; n = 4, l = 1; n = 5, l = 0) первым будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. вслед за подуровнем 4s будет заполняться подуровень 3d. (II правило Клечковского).
Пример 5. Запишите электронную формулу атома бериллия в нормальном и возбужденном состояниях. Изобразите форму валентных электронных облаков.
Решение:
Для стабильного (нормального) состояния:
Электронная формула Be 1s 2 2s 2 .
Форма валентных атомных орбиталей (2s).
Для возбужденного состояния: электронная формула Be · 1s 2 2s 1 2p 1 .
Форма валентных орбиталей возбужденного атома Be:
Форма гибридизированных атомных орбиталей возбужденного атома Be (2 гибридные атомные орбитали) под углом 180 0 :
Пример 6. Почему атом хлора и марганца помещают в одной группе периодической системы элементов? Почему их помещают в разных подгруппах?
Решение:
Электронные конфигурации атомов
Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Mn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
Валентные электроны атома хлора… 3s 2 3p 5 , а атома марганца… 3d 5 4s 2 .
На валентных орбиталях атомов этих элементов находится одинаковые число электронов -7. На этом основании оба элемента помещаются в одну и ту же седьмую группу периодической системе, но в разные подгруппы, т.к. электроны находятся на разных подуровнях.
Пример 7. С позиции электронного строения атома дайте обоснование: какой элемент относится к типу металлов, а какой элемент относится к типу неметаллов. Подтвердите свой ответ значениями электроотрицательностей данных атомов (Na, N).
Решение:
Электронное строение атомов
Na 1s 2 2s 2 2p 3s 1
N 1s 2 2s 2 2p 3
Атом натрия имеет во внешнем слое 1 ê , атом азота 5 ê . Радиус атома натрия больше (n = 3), чем радиус атома азота (n = 2) В атоме натрия связь с ядром валентных электронов значительно слабее, чем в атоме азота. Каждый атом стремится приобрести электронную оболочку инертного газа (s 2 p 6 ). Для этого атому натрия легче отдать 1 ê , а атому азота легче принять 3 ê . Чем больше величина электроотрицательности атома, тем выше неметаллические свойства элемента.
Поэтому атом Na – металл, относительная электроотрицательность
ОЭО(Na) = 0,93
атом N – неметалл, относительная электроотрицательность ОЭО(N) = 3,0.
Пример 8. Запишите электронные формулы атома и ионов железа, сравните их радиусы.
Решение:
Электронные формулы:
атома Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
иона Fe 2+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6
иона Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Радиусы: R (Feº) > R(Fe² + ) > R(Fe³ + )
Задачи и вопросы для САМОКОНТРОЛЯ
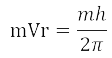 и
уравнении Луи де Бройля
и
уравнении Луи де Бройля
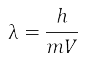 , покажите,
что стационарные орбиты
Бора – это те орбиты, в длине окружности
которых укладываются целое число волн
электрона. Сколько волн электрона
укладывается в длине окружности первой
и второй стационарной орбиты Бора в
атоме водорода (Ответ: одна и две);
Сколько
значений m
1
возможно для электрона энергетического
подуровня со значением: а)l = 2;
б)l = 3;
Определите
по правилу Клечковского последовательность
заполнения электронных орбиталей,
характеризующихся суммой (n + l)
равной: а)5; б)6; в)7;
Ядро
некоторого элемента содержит 16 нейтронов,
а электронная оболочка этого атома -15
электронов. Назвать этот элемент,
записать его символ с указанием заряда
ядра и массового числа.
, покажите,
что стационарные орбиты
Бора – это те орбиты, в длине окружности
которых укладываются целое число волн
электрона. Сколько волн электрона
укладывается в длине окружности первой
и второй стационарной орбиты Бора в
атоме водорода (Ответ: одна и две);
Сколько
значений m
1
возможно для электрона энергетического
подуровня со значением: а)l = 2;
б)l = 3;
Определите
по правилу Клечковского последовательность
заполнения электронных орбиталей,
характеризующихся суммой (n + l)
равной: а)5; б)6; в)7;
Ядро
некоторого элемента содержит 16 нейтронов,
а электронная оболочка этого атома -15
электронов. Назвать этот элемент,
записать его символ с указанием заряда
ядра и массового числа.