ТАҚЫРЫБЫ: Кіріспе. Химиялық зертханаларда жұмыс істеудің жалпы ережелері. Химияның негізгі түсініктері және заңдылықтары. Бейорганикалық заттарды тазарту және тұрақты шамаларын анықтау
Тақырыптың маңыздылығы: Бейорганикалық химия курсының жоғары білім беру жүйесінде негізгі кәсіптік химиялық пәндерді, аналитикалық, органикалық, биологиялық, фармацевтикалық және токсикологиялық химия пәндерін оқып үйренуде алатын орны ерекше. Бейорганикалық химия курсын оқып үйренуде студенттер химияның негізгі түсініктері және заңдылықтарын, бейорганикалық қосылыстардың номенклатурасын және жіктелуін, элементтермен олардың қосылыстарының химиялық қасиеттерімен құрылымын, атомдармен молекулалардың арасындағы химиялық байланыстардың түзілуін, координациялық байланыстарын, бейорганикалық қосылыстарды алудың әдістерін, химиялық реакциялардың бағыттарының ағымын анықтау, тірі жүйелердегі ағымын, кейбір дәрілік заттардың адам ағзасына әсер ету механизмін және олардың бейорганикалық қосылыстарын химиялық талдаудың заманауи әдістерінің негіздерін меңгеруді оқып үйрену.
Зерттеу жұмыстарын жүргізу барысында ең маңыздысы химиялық реагенттердің тазалығы болып табылады. Дәрілік зат ретінде қолданылатын, химиялық заттың тазалығы, оның фармакологиялық қасиетіне байланысты. Зертханада химиялық заттарды тазалауда мына әдістер кеңінен қолданылады, қаныққан ерітінділерден заттарды қайта кристалдау, возгонка және қайта айдау. Заттың тазалығы оның физикалық константасымен (балқу және қайнау температурасы, сыну көрсеткіші және т.б.) тексеріледі.
Сабақтың мақсаты: Бейорганикалық химияның негізгі түсініктері және заңдылықтары, бейорганикалық қосылыстардың номенклатурасын және жіктелуін, бейорганикалық қосылыстардың константасын анықтауын, тазалаудың түрлі әдістерін, алу тәсілдерін оқып үйрету.
Оқытудың міндеттері: бейорганикалық химияның негізгі түсініктері және заңдылықтары, бейорганикалық қосылыстардың номенклатурасы және жіктелуі, бейорганикалық қосылыстардың константасын анықтауы, тазалаудың түрлі әдістері, алу тәсілдері туралы теоретикалық білімдерін қалыптастыру; зертханалық жұмыстарды орындау барысында бейорганикалық қосылыстарды тазалауда және олардың константасын анықтауда, әр түрлі температурада және реакция өнімінің шығымын есептеуде, заттардың ерігіштігін есептеуде практикалық дағдыларын қалыптастыру; студенттерде жұппен және шағын топпен жұмыс жасау барысында коммуникативті дағдыларын қалыптастыру; студенттерде тез тұтанатын, жарылғыш ерітінділермен жұмыс жасау барысында қауіпсіздік техника шараларының ережелерін ұстана отырып, құқықтық құзіреттіліктерін дамыту; студенттерде фармацевтикалық практикада ерітінділерді дайындауда, бейорганикалық заттарды бөліп алуда, бейорганикалық дәрілік заттарды идентификациялауда тазалаудың әдістеріне байланысты қойылған мәселелі сұрақтарды шешуде алған білімдерін қолдана отырып тәжірибелік қабілеттіліктерін дамыту.
САБАҚҚА ДАЙЫНДАЛУҒА АРНАЛҒАН СҰРАҚТАР
Бастапқы білімдері бойынша білуі қажет: 1.Бейорганикалық қосылыстардың негізгі кластарын; 2.Бейорганикалық қосылыстардың номенклатурасын; 3.Бейорганикалық қосылыстардың химиялық қасиеттерімен алу жолдарын.
Негізгі сабақтың тақырыбы бойынша дайындалу қажет: 1. Химияның негізгі түсініктері және заңдылықтары; 2. Моль. Газдың молярлы көлемі. Авогадро заңы; 3. Химиялық формулалар. Химиялық формулалармен теңдеулерді есептеу.
ХИМИЯЛЫҚ ЗЕРТХАНАЛАРДА ЖҰМЫС ІСТЕУДІҢ ЖАЛПЫ ЕРЕЖЕЛЕРІ
Химиялық
зертханада жұмыс жүргізу
барысында төмендегідей заңдылықтарды
білу және сақтау қажет:
Сабақтың
алдында
әдістемелік
нұсқаулықпен, дәріс жазбаларымен,
оқулықтармен танысу
қажет;
Тәжірибелік
жұмыстарды жүргізу алдында жұмыстың
сипаттамасымен толықтай
танысып, жұмысты жүргізуге арналып
жасалған негізгі талаптардың
барлығы толықтай орындалуы
қажет, оқытушыдан сұрастыру арқылы
барлық түсініксіз
сұрақтардың
шешімін тауып, содан кейін
ғана
жұмысқа кірісу керек;
Жұмыс
орны таза және реттелген болуымен қатар
қажетсіз заттармен шашылып жатпауы
қажет. Зертханадан кетер алдында жұмыс
орнын реттеп және суды, газды, тоқ
көздеріне қосылатын
қыздырғыш құралдарды,
сорғыш желдеткіштерді
өшіріп кету қажет;
Реактив
құйылған ыдыстарды кітаптардың,
дәптерлердің
және т.б. заттардың
үстіне қоюға толықтай
тыйым салынады.
Реактивтерді
қолдану алдында мына ережелер қатаң түрде сақталынуы қажет:
а)
реактивтің
жапсырмасындағы
атауын мұқият мән беріп оқу қажет;
б)
барлық
реактивтерді жабық
түрде ұстау қажет және
оларды қолданар алдында ғана ашу керек;
реактивтердің
аузын жабар
алдында, тығындарын
ауыстырып алмау қажет, ауыстырып алған
жағдайда реактивтер былғанып, жарамсыз
болып
қалуы мүмкін;
в)
көпшілік пайдаланатын реактивтерді өз
жұмыс орнына апаруға болмайды;
г)
құрғақ
тұздарды
таза қалақшалармен, арнайы қасықшалармен
ғана алу керек;
д)
егерде, жұмыс барысында затты қандай
мөлшерде алу қажеттігі көрсетілмеген
болса, құрғақ
заттармен
жұмысты пробиркада, ал
ерітіндіні – 1/6 көлемнен пробиркадан
аспайтындай етіп орындауы қажет;
е)
пробиркаға артық мөлшерде
құйылған реактивті қайтадан бастапқы
реактиві бар ыдысқа құюға болмайды;
ж)
құрамында күміс, сынап, бром және йод
бар реактивтердің
қалдықтарын желдеткіш
шкафтардың
астында тұратын
арнайы ыдысқа
құю
қажет.
6. Басшылыққа сәйкес, оқытушының рұқсатынсыз зертханалық жұмысты еш жүргізуге болмайды.
Химиялық заттармен жұмыс жасау кезінде жүргізілетін сақтық шаралары: 1. Улы заттармен жүргізілетін барлық жұмыстар, содай-ақ ерітінділерді буландыру желдеткіш шкафтарда жүргізіледі; 2. Тез тұтанғыш заттармен жұмыс жүргізулер тек қана оттан алыста жүргізіледі; 3. Металдық натриймен және басқада сілтілік металдармен жұмыс жасау кезінде судан сақтау қажет. Сілтілік металдарды құрғақ, керосинде сақтау қажет. Сілтілік металдарды кесуді лаборантқа тапсырып, қоқысқа арналған жәшікке немесе раковинаға тастауға болмайды; 4. Ерітінділерді қыздыру барысында пробирканы ұстағышпен ұстап, пробирканы қозғап отыру керек, сонымен қатар пробирканың аузы жұмыс жүргізіп жатқан кісіге, көршісіне қарамауы қажет; 5. Қыздырылып жатқан сұйықтыққа, балқытылып жатқан затқа бетімен еңкейіп қарамауы керек, себебі, шашырап кетуі мүмкін; 6. Зертханада затты иіскеу қауіпті, пробиркаға еңкейіп көкірекпен толықтай тыныс алуға болмайды, ал өзіне қарай булармен газдарды қолмен қимылдату арқылы желпіп тексеру қажет. Күшән, фосфорлы сутек және т.б. сияқты күшті улы заттарды иіскеуге болмайды; 7. Зертханадағы барлық заттармен жұмыс жасау барысында абай болу қажет, сондай-ақ зертханада қолданылатын заттардың ¾ бөлігі улы болып табылады; 8. Қатты сілтілік заттармен жұмыс жасауда (ірі бөліктерін ступкада ұсақтауда, балқытуға және т.б. жұмыстарға қоспаларды дайындауда) мін детті түрде қорғанысқа арналған көзілдірік кию қажет. Сілтілерді тек қана қысқыштармен немесе пинцеттермен ғана алуға рұқсат етіледі; 10. Концентрлі қышқылдарды сумен араластыруда, әсіресе күкірт қышқылын, өте сақ болу қажет, абайлап құю және аз ғана көлемде қышқылды алып суға құю керек, керісінше болмайды; 11. Сынаптармен жұмыстар арнайы жағдайларда ғана жүргізіледі; 12. Зертханада тамақ ішуге болмайды; 13. Су құбырлары раковиналарына қағаз, сынған шыны, металл қалдықтарын және т.б. заттарды тастауға болмайды. Қолдануға жарамайтын заттарды тастауға арнайы қоқыс жәшіктерімен банкалар қолдану қажет.
Сәтсіз оқиғаларға жедел жәрдем көрсету: 1. Теріге түскен жағдайда (қолға, бетке және т.б.) концентрлі қышқылдар (күкірт, азот және т.б.) тез арада күйген орынды судың көп мөлшерімен ағын судың астында шайып, таниннің спиртті ерітіндісімен немесе 3% калий перманганатының ерітіндісімен шайқап содан кейін мақтадан таңғыш жасап таңу керек. Қатты күйікке алғашқы көмек көрсеткеннен кейін міндетті түрде дәрігерге қаралу қажет; 2. Сілтілі ерітінділермен күйік алғаннан кейін терінің күйік шалған жерін жақсылап шайып, күйік алған жер тегіс болғанға дейін таниннің спиртті ерітіндісімен немесе 3% калий перманганатының ерітіндісімен шайқап содан кейін мақтадан таңғыш жасап таңу керек; 3. Сілтілі ерітінділер шашырағанда, көзге түскен жағдайда тез арада күйген орынды судың көп мөлшерімен ағын судың астында шаю керек. Қатты күйікке алғашқы көмек көрсеткеннен кейін міндетті түрде дәрігерге қаралу қажет; 4. Ыстық заттармен (шыны, заттар және т.б.) күйген жағдайда алдын ала таниннің спиртті ерітіндісімен немесе 3% калий перманганатының ерітіндісімен шайқап таңғыш таңып, ал содан кейін жақпамай жағылған қалыңдатылған таңғыш заттармен таңу қажет; 5. Фосформен күйген жағдайда дененің күйген бетіндегі фосфор қалдығын жақсылап шайып, күйген жерге мыс сульфатының 2% ерітіндісіне малынған таңғыш таңып, міндетті түрде дәрігерге қаралу қажет; 6. Хлормен, броммен, күкіртсутекпен, көміртегі (II) оксидімен уланғанда, зардап шегушіні міндетті түрде таза ауаға шығарып, дәрігерге қаралу қажет; 7. Күшәнмен сынап қосылыстарының, сондай-ақ цианның тұздарымен уланғанда, тез арада дәрігерге қаралу қажет.
Зертханалық жұмыстардың нәтижелерін рәсімдеу
Барлық жұмыстар, студенттермен жеке-жеке жүргізіледі. Зертханалық жұмыстар жүргізіліп бітісімен, барлық анықталған нәтижелер сол сағатта арнайы дәптерге – зертханалық журналға жазылып, рәсімделуі қажет (нәтижелер қорытындыларын жеке қағаздарға немесе парақшаларға жазуға болмайды). Журналдағы жазбалар ұқыпты жазылған болуы керек. Олар реакция теңдеулерін, процестің жүру жағдайын қысқаша нақты, тәжірибенің жүру жағдайын (тұнбалардың түзілуімен еруі, түсінің өзгеруі, газдың бөлінуі) сұрақтардың жауаптарымен қорытындыларын, суреттерін, жұмыстың мазмұнын жазулары керек. Егерде жүргізілетін жұмыс бойынша есептеулер қажет болған жағдайда, есептеулер толығымен жазылуы керек, сатылы есептеулер болатын болса, арасындағы бөлімдері толықтай жазылуы тиіс.
Зертханалық жұмысты рәсімдеу, міндетті түрде жаңа беттен жазылуымен қатар, жүргізілу мерзімі, тақырыбы және атауы жазылуы тиіс. Зертханалық журналдың сыртында аты, тегі, факультеті, курсы және тобы көрсетіледі.
Зертханалық журналды толтырудың үлгісі
Мерзімі: «___» ______________.
Тақырыбы: «______________________».
Тәжірибе № ___ (жұмысты, нұсқаулықты мұқият оқып барып жүргізу керек).
Реакция теңдеулері:________ реакция теңдеулерін молекулалық және ионды түрде жазу керек. Тотығу-тотықсыздану реакцияларында тотықтырғышпен тотықсыздандырғышты көрсете отыра электр онды балансын құру.
Анықтау:__________ анықтауды қысқаша жазу керек: түсі, иісі, газдың бөлінуі және тұнбаның түзілуі.
Қорытынды:____________.
АҚПАРАТТЫ-дидактиКАЛЫҚ бөлім
Химияның негізгі түсініктері және заңдылықтары.
Химия – затты, олардың құрамын, құрылысын, қасиеттерін, өзгеріске ұшырауын зерттейтін, сондай-ақ өзгерістерге ұшыратудың себептерін аны қтайтын ғылым.
Химия пәні – заттар және олардың өзгеріске ұшырауы.
Зат – белгілі бір жағдайда физикалық және химиялық қасиеттерге ие материяның әр бір жеке түрі.
Реагент – бұл өзіне тән құрамымен құрылысы бар химиялық қосылыс. Химиялық элемент – бірдей оң зарядты ядросы бар атомның белгілі түрі. Химиялық элемент химиялық белгіні білдіреді.
Жай заттар – бір элемементтің атомынан тұратын зат.
Күрделі заттар немесе химиялық қосылыстар – әр түрлі элементтердің атомдарынан тұратын зат. Күрделі заттардың құрамы химиялық формулалардың көмегіне жүгінеді.
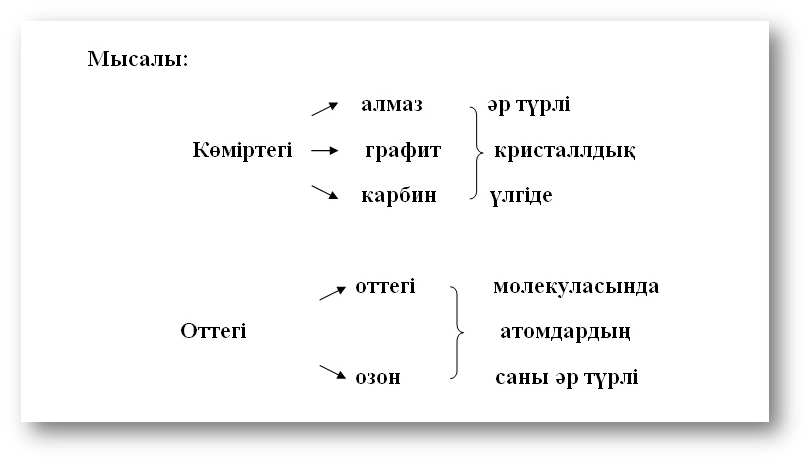
Аллотропиялық түрөзгерістер – бұл, химиялық элементтердің құрамымен құрылысы бойынша әр түрлі болып келетін, бірнеше жай заттарды түзетін құбылыс.

Көміртек бірлікпен алынған атом массасын (A r ) атомдық салмақ дейді немесе берілген элементтің атомының салмағы көміртек атомы салмағының 1/12 бөлігінен неше есе ауыр екендігін көрсететін сан.
Көміртек бірлікпен алынған молекула массасын (М r ) молекулалық салмақ дейді немесе берілген заттың молекуласының салмағы көміртек атомының салмағының 1/12 бөлігінен неше есе ауыр екендігін көрсететін сан, мысалы М r (Н 2 О)=18)
Атомдық масса деп сан жағынан элементтің атомдық салмағына тең етіп алынған сол элементтің грамм санын айтады.
Молярлық масса деп сан жағынан заттың молекулалық салмағына тең етіп алынған сол заттың грамм санын айтады.

n (x) – заттың саны, моль
m (x) – заттың массасы (х), г, кг
M (x) – молярлық массасы, г/моль
Заттың молярлық массасының мәні – зат массасының зат мөлшеріне қатынасы, немесе 1 моль заттың массасы, өлшем бірлігі кг/моль немесе г/моль:
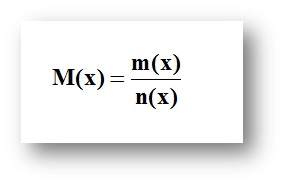
Химиялық құбылыстар немесе химиялық реакциялар – заттардың бір түрден екінші түрге ауысуы, бастапқы түрден құрамымен қасиеттері бойынша (атомдарындағы ядролардың құрамының өзгеріске ұшырамай) өзгеруі арқылы жүретін құбылыс. Мысалы, магнийдің оттегінде жануы: 2Mg+O 2 =2MgO.
Физикалық құбылыс – атомдарындағы ядроларының құрамының өзгеруі арқылы жаңа заттардың түзілуі немесе заттың физикалық жағдайының яғни түрінің өзгеруі. Мысалы, магнийдің оттегінде жануы жылумен жарықтың бөлінуімен аяқталады.
Химиялық тепе-теңдік – химиялық реакциялар, химиялық формулалармен белгілердің, химиялық заңдылықтардың сақталынуының көмегімен жүзеге асады. Химиялық тепе-теңдікте бастапқы зат реакцияның сол жағына, ал шыққан өнім оң жағына жазылады:
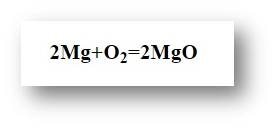
Стехиометриялық коэффициент – химиялық реакциялардың тепе-теңдіктерінде заттың формулаларының алдына қойылатын коэффициент.
Оксидтер – екі элементтен тұратын, оның бірі міндетті түрде оттегі болатын химиялық қосылыс.
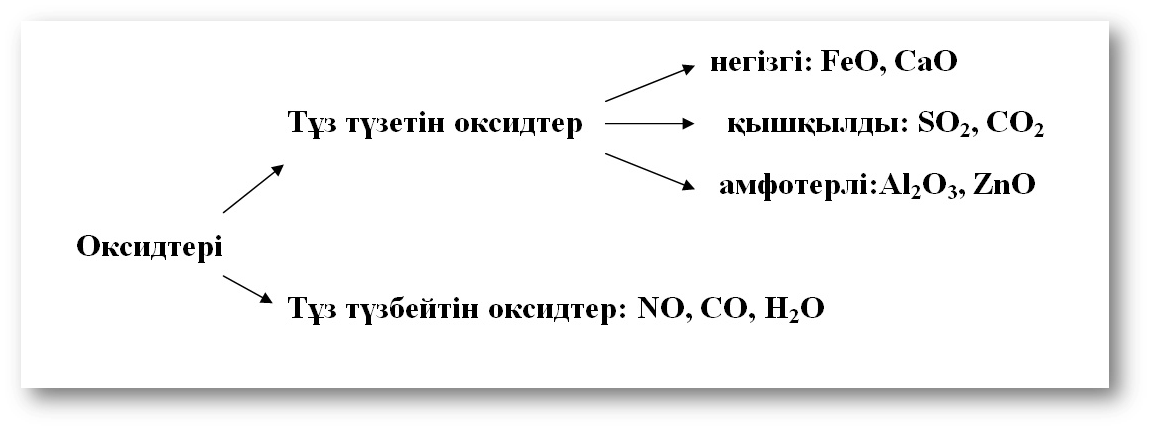
Негіздер – сулы ерітінділерде анион ретінде тек қана гидрокид-ионын түзетін электролиттер:
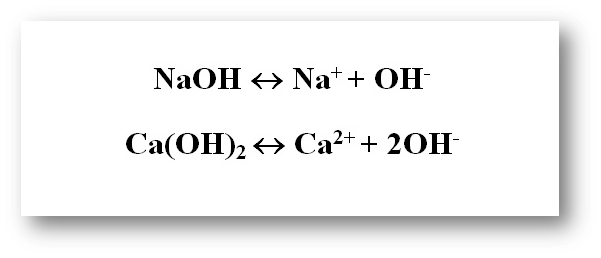
| Негіздер | ||||
| Бір қышқылды | Екі қышқылды | Көп қышқылды | Еритін | Ерімейтін |
| NaOH, KOH | Ca(OH) 2 , Cu(OH) 2 | Al(OH) 3 , Fe(OH) 3 | NaOH, Ba (OH) 2 | Cu(OH) 2 |
Қышқылдар – сулы ерітінділерде катион ретінде тек қана сутек-ионын түзетін электролиттер:
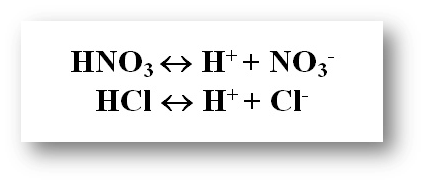
| Қышқылдар | |||||||
| Оттекті | Оттексіз | Бір – негізді | Екі – негізді | Көп негізді | Күшті | Орташа | Әлсіз |
| H 2 SO 4 , H 2 CO 3 | HCl, H 2 S | HCl, HNO 3 | H 2 SO 4 , H 2 S | H 3 PO 4 , H 3 AsO 4 | HCl, H 2 SO 4 | Н 3 PO 4 , H 2 SO 3 | H 2 CO 3 , H 2 S |
Тұздар – сулы ерітінділерде катион ретінде металл ж әне анион ретінде қышқыл қалдығын түзетін электролиттер:
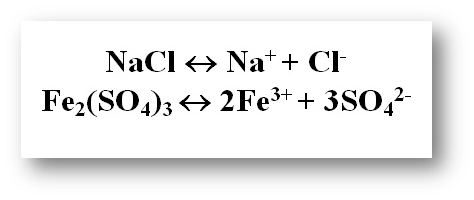
| Тұздар | ||||||
| Еритін | Ерімейтін | Орташа | Қышқылдық | Негіздік | Қос | Кешенді |
| NaCl, KNO 3 , Na 2 SO 4 , Ca (HCO 3 ) 2 | C CaCO 3 , Ca 3 (PO 4 ) 2 , Mg 3 (PO 4 ) 2 | Na 2 SO 4 , Ca 3 (PO 4 ) 2 , MgCO 3 | NaHCO 3 , Ca(H 2 PO 4 ) 2 , KHSO 3 | (CuOH) 2 CO 3 , FeOHCl 2 , Al(OH) 2 NO 3 | KAl (SO 4 ) 2 , KNaCO 3 , KCr (SO 4 ) 2 | K 3 [Fe(CN) 6 ], K 4 [Fe(CN) 6 ] |
Химиялық реакциялар
| Жылудың бөлінуінің немесе жұтылуының белгілеріне байланысты | Қайтымдылығының белгілеріне байланысты | Реакцияланатын заттардың құрамына кіретін атомдардың тотығу дәрежелерінің өзгеруінің белгілеріне байланысты | Бастапқы және соңғы заттардың сандарының өзгеруінің белгілеріне байланысты | ||||||
| Экзотер миялық | Эндотер миялық | Қайтымды | Қайтымсыз | Тотығу дәрежесінің өзгеруінсіз | Тотығу дәрежесінің өзгеруімен | Қосылу | Орынбасу | Айырылу | Алмасу |
| ∆Н 0 < 0 | ∆Н 0 > 0 | 3Н 2 + N 2 2NH 3 | 2Fe + O 2 2FeO | HCl + NaOH = NaCl + H 2 O | 2Mg + O 2 = 2MgO | 2Mg + O 2 = 2MgO | CuO + H 2 = Cu + H 2 O | CaCO 3 = CaO + CO 2 | KOH + HCl = KCl + H 2 O |
Лабораториялық-практикалық жұмыс
Химиялық заттарды тазалаудың әдістері
Химиялық зертханаларда, қолданылатын заттың тазалық дәрежесіне көп көңіл бөлінеді.
Жеке химиялық заттар белгілі бір құрамға ие болуымен қатар, өзіне тән қасиеттерге: кристаллизациямен тұрақты қайнау температурасына, ал сұйық заттар – қайнау температурасымен, тығыздықпен сыну көрсеткіштеріне және т.б. ие.
Заттың тазалығын тексереді: Физикалық әдістермен: балқу және қайнау температураларын анықтаумен, кристаллизациялар; Химиялық әдістермен: заттың сандық және сапалық құрамы.
Химиялық
реактивтер тазалық дәрежесіне қарай бірнеше түрге жіктелінеді, сипаттамалары №1 кестеде келтірілген.
№1 кесте
Химиялық реактивтердің
жіктелінуі
| Реактивтердің жіктелінуі | Белгіленуі | Заттың негізгі құрамы, % | Қоспаның құрамы, % |
| Таза | т. | 98 кем емес | 0,01-0,5 |
| Талдауға арналған таза | т.а.т. | 99 кем емес | 0,1 ге дейін |
| Хими ялық таза | х.т. | 99 кем емес | 1*10 -3 -1*10 -5 |
| Ерекше таза | ер.т. | 100-ге жа қын | 1*10 -5 -1*10 -10 |
Заттарды тазалауда қолданылады: Сұйық заттарды тазалауда қайнау кезінде ыдырамайтын, дистилляция немесе қайта айдау әдістері. Тазаланатын зат сұйықтан бөлініп және бу күйіне ауысады; Қатты заттарды тазалауда, яғни ыдыраусыз сұйық күйден бу күйіне ауысып, салқын бетте кристалл түріне айналса сублимация немесе возгонка әдісі қолданылады; Қайта кристаллизациялау әдісі: әр түрлі температуралардағы заттардың әр түрлі ерігіштіктеріне негізделген қатты заттарды тазалауда қолданылады.
Заттарды идентификациялау
Заттарды идентификациялауда балқу, қайнау температураларын, кристаллизациялану температураларын, сыну көрсеткіштерін анықтаумен қатар, кристалл үлгілерін микроскоп пен қарап зерттейді. Сұйықтардың және газдардың тазалығын анықтау хроматографиялық әдіспен жүргізіледі. Химиялық заттың сәйкестігін тексеру, заттың кестедегі мәндері бойынша (анықтамаларда келтірілген) физико-химиялық константаларының сәйкестіктеріне қарай сараптап жүргізіледі.
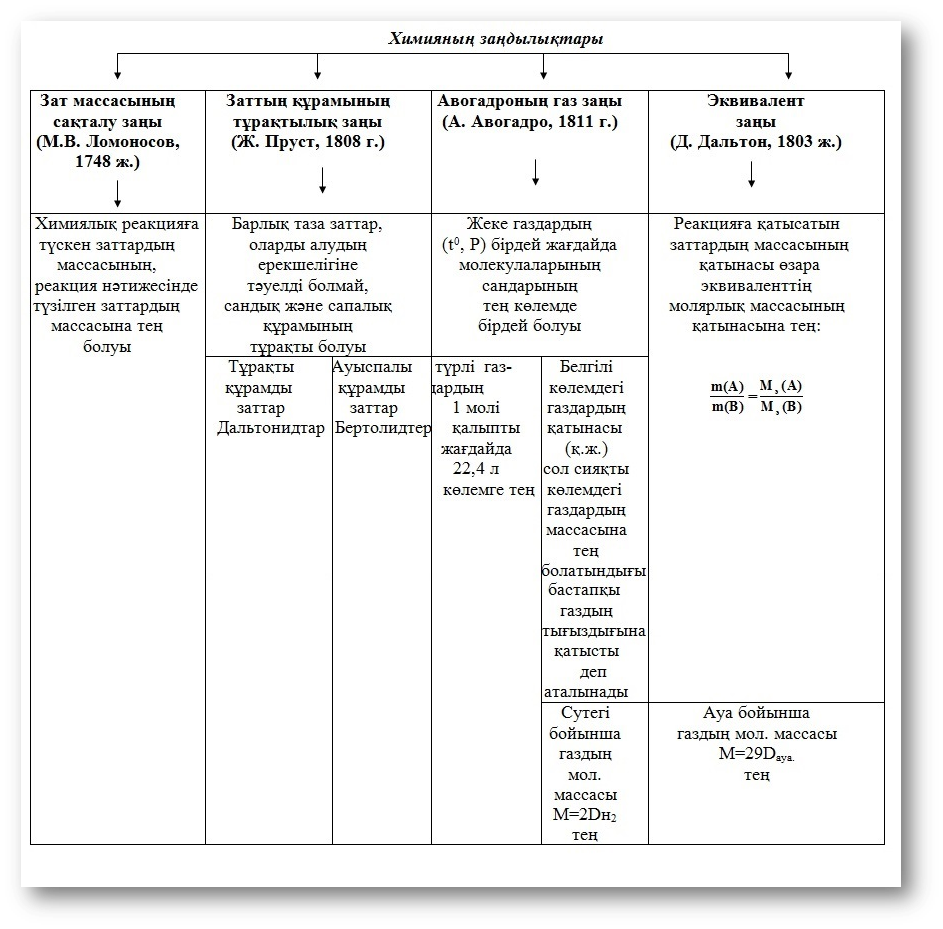
№1-тәжірибе. Еріткішті дистилляция тәсілімен тазалау және оның қайнау температурасын анықтау.
1. Дистилляцияға арналған аспапты құрастыр. Вюрц колбасына (1) көлемі 2/3 дейін еріткішті құйыңыз, суды кері мұздатқыш (3) арқылы жіберіңіз және жанғышты жағыңыз.
2. Колбадағы еріткіш қайнаған соң, бу мұздатқышқа көтерілгенше термометр (2) бойынша қайнау температурасын белгілеп алыңыз.
3.Дистиляттың 25-50 мл жинап алып, оның тазалығын тексеріңіз (қайнау температурасы, тығыздығын, сынғыш бұрышын).
1-сурет.
Сұйық заттарды қайта айдауға арналған құрал: 1-Вюрц колбасы; 2-термометр; 3-Либих мұздатқышы; 4-аллонж; 5-қабылдағыш колба.
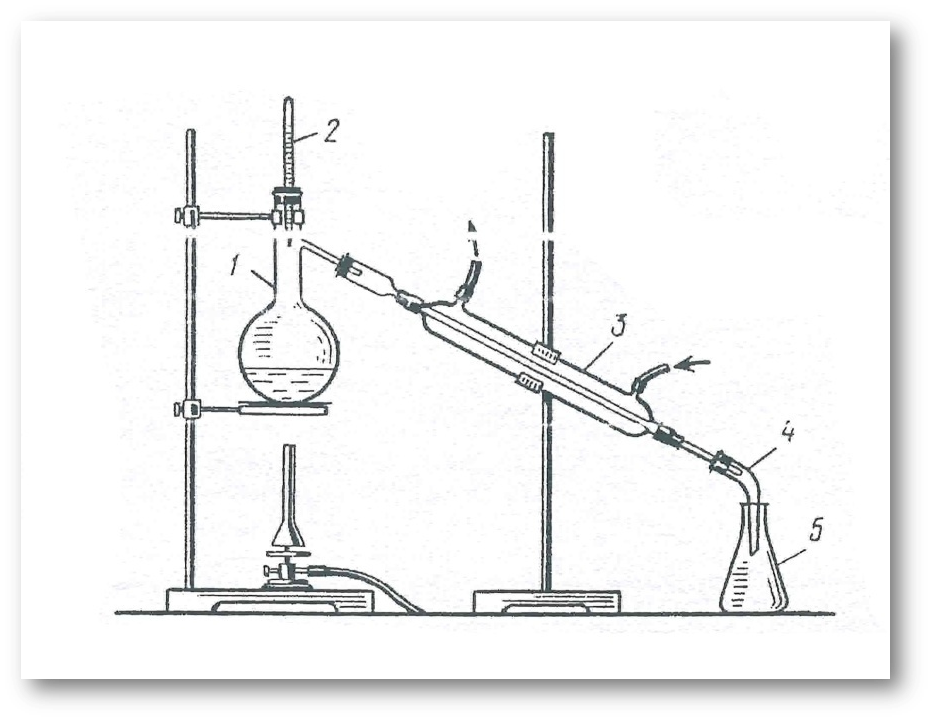
№2-тәжірибе. Заттарды түтіндету арқылы тазарту жолы.
1. Берілген заттың (йодтың, нафталиннің, бензол қышқылының) 0,1 техникалық таразыға өлшеп алып, оны түтіндетуге арналған стаканға салыңыз.
2. Стаканды дөңгелек түпті салқын суы бар колбамен жабыңыз және оны газ жанғышпен ақырындап қыздырыңыз.
3. Колбаның түбінде пайда болған кристалдарды жинап алып,өлшеп, оның шығымын есептеңіз.
2-сурет. Заттарды түтіндету арқылы тазартуға арналған құрал: 1-термотұрақты стакан; 2-дөңгелек түпті колба;
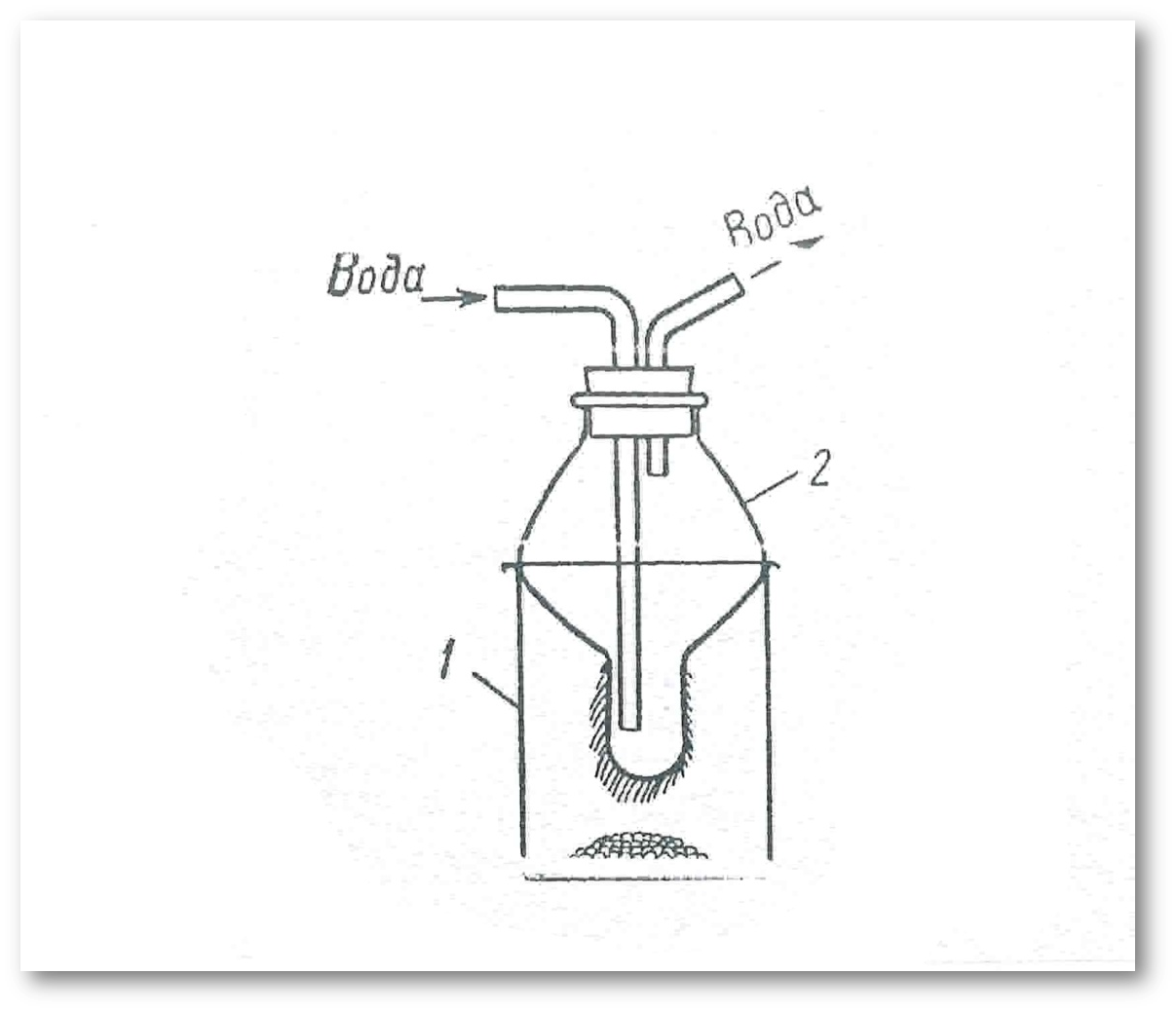
№3-тәжірибе. Қаныққан ерітінділерден заттарды қайта кристалдау.
Қайта кристалдау әдісі қатты заттарды тазалауда, кез келген ерітінділерде әр түрлі температураларда рекшеленеді. Бейорганикалық заттарды қайта кристалдауда, көбінесе ерітінділер ретінде суды қолданылады.
Судағы кейбір заттардың әр түрлі температуралардағы
(г/100г судың, салмағы.%) ерігіштігі*
| Зат | Температура 0 С | ||||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 90 | |
| NaCI | 26,3 | 26,3 | 26,4 | 26,5 | 26,7 | 26,8 | 27,0 | 27,5 | 28,1 |
| CuSO 4 *5H 2 O | 12,5 | 14,8 | 17,2 | 20,0 | 22,5 | 25,0 | 28,5 | 35,5 | 43,0 |
| Na 2 CO 3 *10H 2 O | 6,5 | 11,1 | 17,7 | 28,4 | 33,2 | 32,2 | 31,7 | 31,4 | 31,3 |
| Na 2 B 4 O 7 ·10H 2 O | 1,3 | 1,6 | 2,7 | 3,9 | 6,7 | 10,5 | 20,3 | 31,5 | 41,0 |
* мәліметтер химиктің қысқаша анықтамасынан алынған, М.,ВШ.,1984
Орындалу әдісі: 1. Тазаланған заттың қаныққан ерітіндісін жоғары температурада (су үшін 80-100 0 С) азғантай өлшемін қаныққан ерітінді түзілгенше еріту арқылы даярлаңыз; 2. Алынған ерітіндіні жақсылап араластырып, ерітіңіз және сүзгі қағазбен химиялық стақанға сүзіңіз; 3. Ерітінді суыған соң, түскен кристалдарды сүзіп алып, кептіріңіз. Ерітінді суыған сайын, тазаланған заттың кристалл тұнбалары көбірек түзіледі; 4. Түзілген кристалдарды сүзгілеп, суыған ерітіндінің аз ғана көлемімен шайып, кептіріңіз.
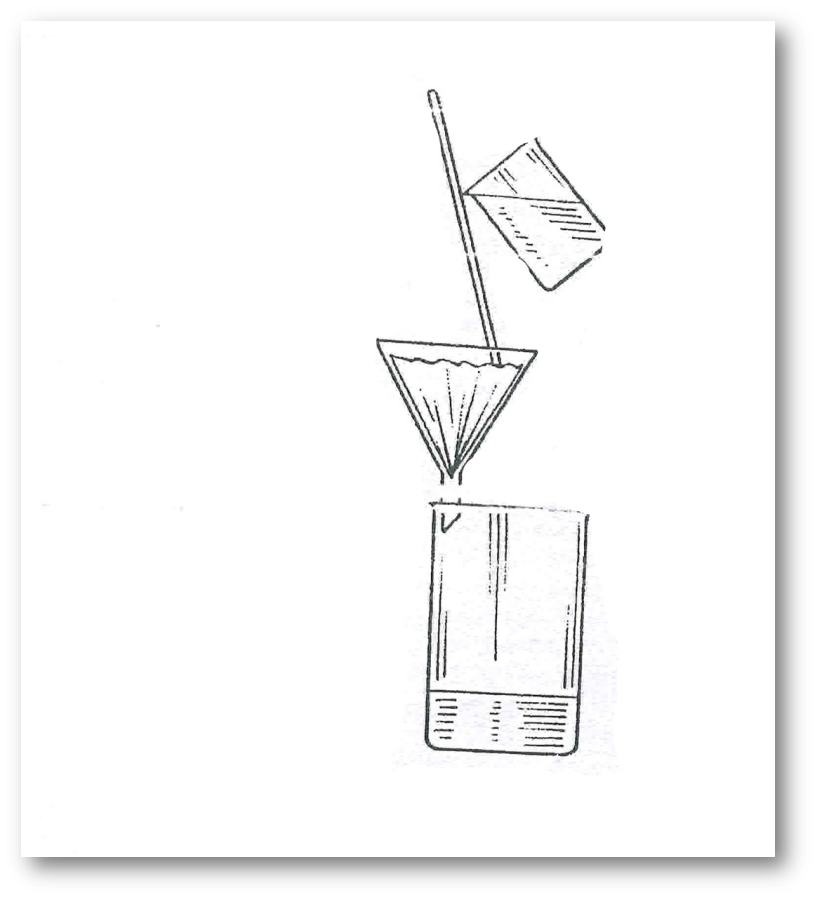
3-сурет. Сүзгіде қатпарлы сүзгішпен сүзгілеу
№4-тәжірибе. Na 2 B 4 O 7 ·10H 2 O бураны тазалау*
Техникалық бураны 12 грамм массалық салмақта, техникалық таразыда өлшеп алып, 50 мл сыйымдылықтағы термотұрақты стаканға (немесе 50 мл өлшемдегі коникалық колбаға) салып, үстіне 20 мл су құйып, 70-75 0 С ерітеді, сосын ерітіндіні стаканға қатпарлы сүзгіде сүзеді (3-сурет). Сүзгілеуді сүзгіште кристадану түзілмей тұрып, тезірек жүргізу қажет. Сүзіндіні мұзды суда үнемі шыны таяқшамен араластыра отырып, суытады. Бураның түзілген кристалдарын Бюхнер сүзгішінде сүзгілейді (4-сурет) және 1-2 мл мұзды суда шайғындайды. Сүзгіш қағаздарының араларынан алынған кристалдарды кептіру керек. Кристалдарды өлшеп және тазаланған бураның пайыздық (%) шығымын есептейді.
Алынған өнімнің, бура кристалдарының балқу температураларының тазалығын, балқу температураларын анықтайтын арнайы құрал арқылы (номер 5 тәжірибедегі суреттегідей) тексеру керек. Бураның теориялық балқу температурасы 75 0 С.
* Бейорганикалық химия практикумы. Н.А. Остапкевич ред, М., ВШ, 2001, б.10.
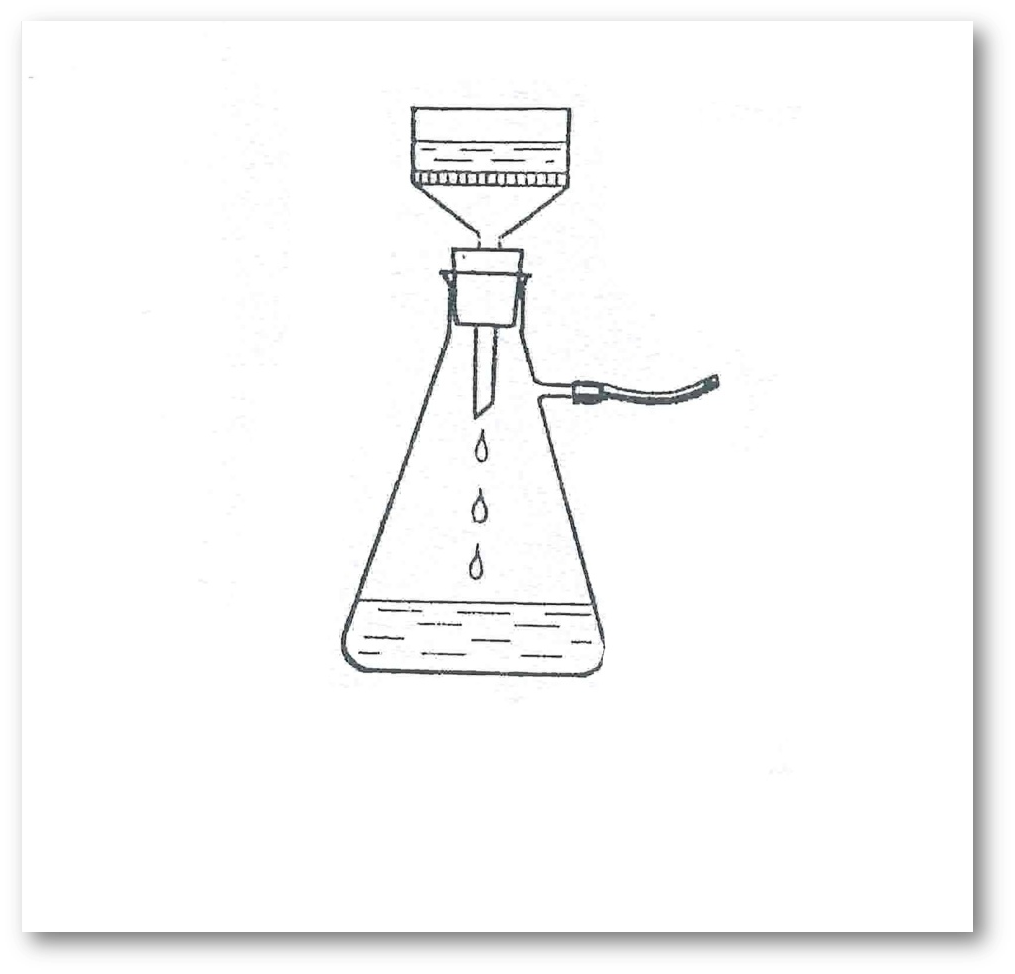
4-сурет. Бюхнер сүзгішінде сүзгілеу
№5-тәжірибе. Заттың балқу температурасын анықтау.
1.Зерттелуге алынған затты шыны түтікшеге толтырып, нығыздаңыз және термометрге бекітіңіз.
2.Термометрді балқу температураны анықтайтын аспапқа енгізіңіз.
3.Аспапты біртіндеп зат түгел балқығанша қыздырыңыз.
4.Зерттейтін заттың балқу температурасын жазып алып, оны әдебиеттегі мәліметтермен салыстырыңыз.
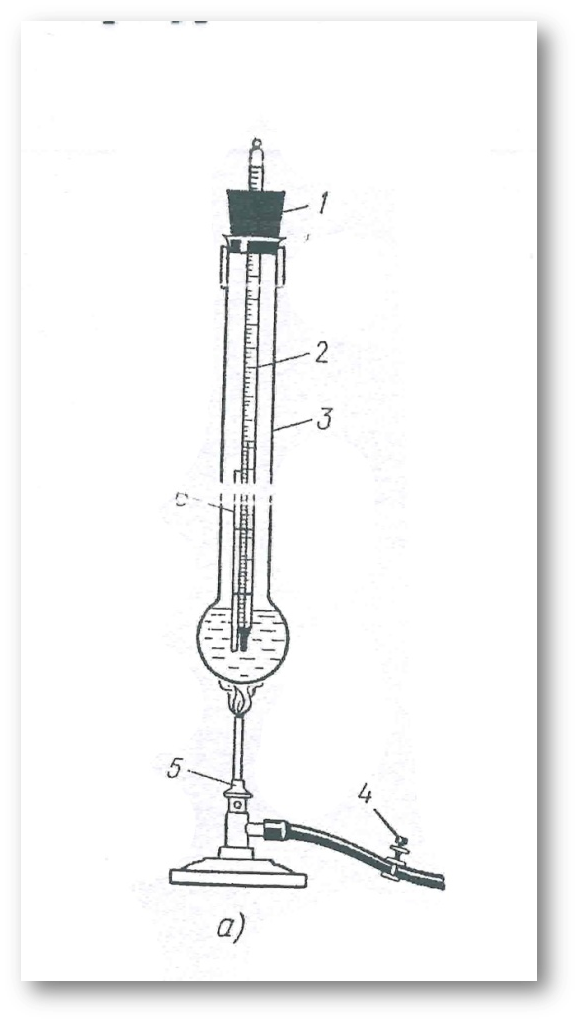
5-сурет. Балқу температурасын анықтайтын құрал: 1-термометр; 2-капилляр; 3-ұзын мойынды термотұрақты колба; 4-қыздырғыш ; 5-от көзі.

6-сурет. Затты капиллярға нығыздап толтырып және термометрге бекіту.
Өз бетімен дайындалуға тапсырмалар
І. Оқу бағдарламасының материалын талқылаңыз: Химия пәні, міндеттері мен тәсілдері. Химиялық құбылыстардың және процесстердің материя қозғалысы формасының химиялық түрі, көрінісі ретіндегі өзгешеліктері. Химияның жаратылыс тану ғылымдары арасында алатын орны. Химия дамуының негізгі кезеңдері. Медицина мен фармацияны дамытудағы химияның мәні. Отандық (Ломоносовтың, Менделеевтің, Бутлеровтың және басқалардың) және шетелдік ғалымдардың химияны дамытудағы үлесі. Химияның ғылыми-техникалық прогресстегі ролі. Зат. Химиялық заттардың тазалығы. Тазалық дәрежесінің шартты белгілері (заттардың тазалығы бойынша сапасын бағалау). Заттарды тазалаудың теориялық негіздері, заттардың физикалық тұрақты шамалары, заттарды бөліп алу (идентификациялау) әдісі.
ІІ.
Бақылау сұрақтарға жазбаша жауап
беріңіз:
1.
Д.И. Менделеевтің
периодтық
жүйесін
қолдана отырып,
мына химиялық
формулаларды
құрастырыңыз:
селен, хлорлылы, метафосфор қышқылдары,
мырыш пен хром (ІІІ) гидроксиді;
2.
Алюминий гидроксиді мен фосфор
қышқылыныңәне
қышқыл тұздарының
химиялық
таңбаларын
жазып атаңыз;
3.
Тұздардың
жіктелуі, аталуы;
4.
Мына
өзгерістерді
жүзеге асыруға болатын реакциялар
теңдеулерін жазыңыз:
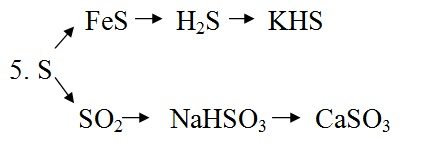
1. ZnO → Na
2
ZnO
2
→ ZnOHCl → ZnCl
2
→ Zn
2. Fe → FeCl
2
→ Fe(OH)
2
→ FeSO
4
→ Fe
3. P → P
4
O
10
→ H
3
PO
4
→ Na
3
PO
4
→ Ca
3
(PO
4
)
2
4. N
2
→ NH
3
→ (NH
4
)
2
SO
4
→
NH
4
Cl → NH
3
→ NH
4
NO
3